原子参数
原子的参数包括:
- 原子半径
- 电离能:气态原子或离子失去电子所需吸收的能量。
- 电子亲和能:气态原子或离子得到电子所需放出的能量。
- 电负性:在一个分子中,一个原子将电子吸引到它自身的能力(得失电子能力 / 氧化或还原能力)。其中电离能和电子亲和能综合起来可以决定电负性。
1 原子半径
电子云没有边界,因此目前所有的原子半径都是在结合状态下测定的。半径可以分成下列三种情况:
- $r \lt \frac{d}{2}$ 范德华半径——稀有气体。两个相邻原子之间不直接接触。
- $r=\frac{d}{2}$ 金属半径——金属。原子排列可以视为等径小球的密堆。
- $r \gt \frac{d}{2}$ 共价半径——其它分子(如水( )二氧化碳)。两个相邻原子有一定的重合。
规律 $1$:同一族的元素随着周期的增大,原子半径自上而下增大。
原因:电子层数增多,原子半径增大。
规律 $2$:周期内随着原子序数的增大,原子半径自左向右减小。
原因:电子层数不变的情况下,有效核电荷数的增大导致核对外层电子的引力增大。
练习
- 比较半径的大小
- $r(\text C)$( )$r(\text N)$( )$r(\text O)$
- $r(\text O)$( )$r(\text S)$( )$r(\text{Se})$
- $r(\text O^{2-})$( )$r(\text F^-)$( )$r(\text{Na}^+)$
- $r(\text{Fe})$( )$r(\text{Fe}^{2+})$
- $r(\text{Fe}^{2+})$( )$r(\text{Fe}^{3+})$
解:
- 这三个原子属于同一周期,因此核电荷数越大,半径越小。应填 $\gt$、$\gt$。
- 这三个原子属于同一族,因此核电荷数越大,半径越大。应填 $\lt$、$\lt$。
- 这三个离子的核外电子相同,因此应当比较核电荷数——核电荷数越大,半径越小。应填 $\gt$、$\gt$。
- 这两个离子核电荷数相同,而前者的电子数较多,因此应填 $\gt$。
- 同上,应填 $\gt$。
思考
主族元素、过渡元素、镧系锕系元素的原子半径减小幅度如何?
答:
- 主族元素:电子增加在最外层,对原来电子的屏蔽参数 $\sigma$ 小,有效核电荷增大多,原子半径减小幅度大;
- 过渡元素:电子增加在次外层,对原来电子的屏蔽参数 $\sigma$ 较大,有效核电荷增大相对少,原子半径减小幅度小很多;
- 镧系锕系:电子增加在倒数第三层,对原来电子的屏蔽参数 $\sigma$ 大,有效核电荷增大少,原子半径减小幅度非常小。
2 电离能
元素的第一电离能图像:
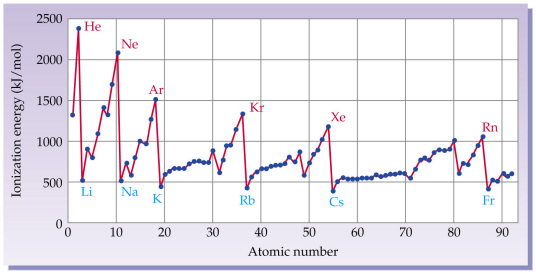
不难发现,同周期呈上升趋势,同主族呈现下降趋势。$\text{II A}$、$\text{III A}$、$\text{V A}$、$\text{VI A}$ 附近出现异动,因为此时达到半满或全满的状态,不容易失去(一个)电子。
同理可以通过级别来反映元素丢失对应数量电子所需的电离能。例如,对于氮原子来说:
| 电离能级数 | 电离能/eV | $\Delta$/eV | $\Delta_\Delta$/eV |
|---|---|---|---|
| l1 | $14.53$ | / | / |
| l2 | $29.60$ | $15.07$ | / |
| l3 | $47.45$ | $17.85$ | $2.78$ |
| l4 | $77.48$ | $30.43$ | $12.58$ |
| l5 | $97.30$ | $19.82$ | $-10.61$ |
| l6 | $552.15$ | $454.85$ | $435.03$ |
注意到,电离能在 l3 和 l4 处变化趋势相比之前较大,而在 l5 和 l6 处变化速度急剧变大。这是由于氮元素 $1 \text s^2 2 \text s^2 2 \text p^3$ 的结构所导致的——连续失去 $3$ 个电子的过程中电离能分布较均匀,但在失去第 $4$ 个电子时会破坏 $2 \text p$ 层全空的稳定结构,因此变化趋势较大。而在到达 $1 \text s$ 和 $2 \text s$ 层的交界处时,由于能层的变化,电离能相比之前变化速度的变化量更加明显。
3 电子亲和能
在某种程度上,电子亲和能所表示得到电子的过程可以视为电离能失去电子的逆向过程。
4 电负性
| $\text H \ 2.1$ | ||||||||
| $\text{Li} \ 1.0$ | $\text{Be} \ 1.5$ | $\text B \ 2.0$ | $\text C \ 2.5$ | $\text N \ 3.0$ | $\text O \ 3.5$ | $\text F \ 4.0$ | ||
| $\text{Na} \ 0.9$ | $\text{Mg} \ 1.2$ | $\text{Al} \ 1.5$ | $\text{Si} \ 1.8$ | $\text P \ 2.1$ | $\text S \ 2.5$ | $\text{Cl} \ 3.0$ | ||
| $\text K \ 0.8$ | $\text{Ca} \ 1.0$ | $\text{Ga} \ 1.6$ | $\text{Ge} \ 1.8$ | $\text{As} \ 2.0$ | $\text{Se} \ 2.4$ | $\text{Br} \ 2.8$ | ||
| $\text{Rb} \ 0.8$ | $\text{Sr} \ 1.0$ | $\text{In} \ 1.7$ | $\text{Sn} \ 1.8$ | $\text{Sb} \ 1.9$ | $\text{Te} \ 2.1$ | $\text I \ 2.5$ | ||
| $\text{Cs} \ 0.7$ | $\text{Ba} \ 0.9$ | $\text{Tl} \ 1.8$ | $\text{Pb} \ 1.9$ | $\text{Bi} \ 1.9$ | $\text{Po} \ /$ | $\text{At} \ /$ |
上表给出了部分元素的电负性。电负性的用途较多:
判断元素为金属元素还是非金属元素:
- 非金属元素:电负性 $\ge 1.8$;电负性越大,非金属性越强
- 金属元素:电负性 $\le 1.8$;电负性越小,金属性越强
判断化合价的正负:在只有两个元素且每个元素化合价一致的化合物中,电负性较大的显负价,较小的显正价。
判断化学键的类型:
- 成键的两种元素的电负性之差 $\gt 1.7$:成离子键
- 成键的两种元素的电负性之差 $\lt 1.7$:成共价键
对角线规则:左上右下对角线相邻的元素的电负性相近,性质相似。