元素周期表
我们不妨先根据构造原理写出每一能层的电子数:
| $1 \text s$ | $2 \text s$|$2 \text p$ | $3 \text s$|$3 \text p$ | $4 \text s$|$3 \text d$|$4 \text p$ | $5 \text s$|$4 \text d$|$5 \text p$ | $\cdots$ |
|---|---|---|---|---|---|
| $2$ | $2$|$6$ | $2$|$6$ | $2$|$10$|$6$ | $\cdots$ | $\cdots$ |
| $2$ | $4$|$10$ | $12$|$18$ | $20$|$30$|$36$ | $54$ | $\cdots$ |
| $\text{He}$ | $\text{Ne}$ | $\text{Ar}$ | $\text{Kr}$ | $\text{Xe}$ | $\text{Rn}$ |
根据这些可得到元素周期表的雏形:
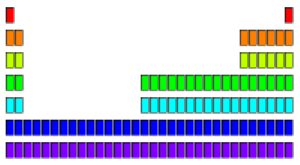
因此我们可以归纳出下列的规律:
- 第 $n$ 周期从 $n \text s^1$ 开始,到 $n \text p^6$ 结束(除第一周期外)。
- 同周期元素红出现的电子排布轨道能量接近,可以称为一个能级组。
思考
- 列出第 $n$ 周期的能级组
解:第一周期的能级组有 $1 \text s$,第二周期有 $2 \text s$ 和 $2 \text p$。依此类推,可以得到一般规律(该能级组包含对应能级的前提是该能级存在):
$$n \text s,\cdots,(n-2) \text f,(n-1) \text d,n \text p$$
- 第十周期有多少个原子?
解法一:第 $n$ 周期有 $2 \lceil \frac{n+1}{2} \rceil^2$ 个原子。将 $n=10$ 代入得共有 $2 \times 6^2=72$ 个原子。
解法二:根据第 $1$ 题的启发,可以先列出第十周期的能级组。
先列好两端的 $\text s$ 和 $\text p$:
$$10 \text s,10 \text p$$
再依次添加剩余的轨道:
$$10 \text s,{\color{green}{9 \text d}},10 \text p$$
$$10 \text s,{\color{green}{8 \text f}},9 \text d,10 \text p$$
$$10 \text s,{\color{green}{7 \text g}},8 \text f,9 \text d,10 \text p$$
$$10 \text s,{\color{green}{6 \text h}},7 \text g,8 \text f,9 \text d,10 \text p$$
$$10 \text s,{\color{red}{5 \text i}},6 \text h,7 \text g,8 \text f,9 \text d,10 \text p$$
注意到 $5 \text i$ 并不存在,因此能级组为:
$$10 \text s,6 \text h,7 \text g,8 \text f,9 \text d,10 \text p$$
进行累加,可得最多可容纳的电子数为
$$2+6+10+14+18+22=\frac{(2+22) \times 6}{2}=72$$
因此第十周期有 $72$ 个原子。