原子的构造原理 题解
练习 1
A. 和电子层相关联的是能层而不是能级,A 错误。
B. 每个能层有轨道 $0 \sim n-1$,因此可容纳的总电子数为 $2 \sum_{i=0}^{n-1} (2i+1)=2(n^2-n+n)=2n^2$,B 正确。
C. 在不考虑能级交错的情况下,不同能层按能层从小到大的顺序能量从低到高,相同能层按能级从小到大的顺序能量从低到高。而能级交错只是对部分能级的交换,但本身能量没有改变,因此同一能层的不同能级能量不可能相同。C 错误。
D. 与 C 类似,能层不同时层数越大,能量越大。D 错误。
练习 2
$\text O$ 的电子排布为 $1 \text s^2 2 \text s^2 2 \text p^4$。形成阴离子时可直接追加电子,因此 $\text O^{2-}$ 的电子排布为 $1 \text s^2 2 \text s^2 2 \text p^6$,故 B 错误。
练习 3
最外层电子排布可以反映最外层电子数,从而体现元素的化合价。而 $\text X_2 \text Y_3$ 这一形式也表明 $\text X$ 化合价为正,$\text Y$ 为负。
A. $\text X$ 和 $\text Y$ 的最外层电子数分别为 $2+1=3$ 和 $2+5=7$。因此 $\text X,\text Y$ 化合价分别为 $+3,-1$,不合题意。
B. $\text X$ 和 $\text Y$ 的最外层电子数分别为 $2+3=5$ 和 $2+4=6$。因此 $\text X,\text Y$ 化合价分别为 $+5,-2$,不合题意。
C. $\text X$ 和 $\text Y$ 的最外层电子数分别为 $2+1=3$ 和 $2+4=6$。因此 $\text X,\text Y$ 化合价分别为 $+3,-2$,符合题意。
D. $\text X$ 和 $\text Y$ 的最外层电子数分别为 $2$ 和 $2+3=5$。因此 $\text X,\text Y$ 化合价分别为 $+2,-3$,不合题意。
练习 4
C 中 $2 \text p$ 没有排满,而该元素又不是 $\text{Cr}$ 和 $\text{Cu}$ 的特例,因此 C 不符合题意。
练习 5
$3 \text d$ 轨道上排满后应该有 $6$ 个电子,而现在只有 $5$ 个电子。因此只可能有两种情况:
- 某一元素排到 $3 \text d$ 前只差 $5$ 个电子就可以排完。因此该元素电子数为 $2+2+6+2+6+2+5=25$,即为 $_{25}\text{Mn}$。
- 该元素符合洪特规则补充条例,即为 $_{24}\text{Cr}$。
$\text{Mn}$ 和 $\text{Cr}$ 的排布式分别为 $3 \text d^5 4 \text s^2$ 和 $3 \text s^2 3 \text p^6 3 \text d^5$,因此 D 符合题意。
练习 6
A. 同一名称的能级所含轨道数相同,差别只在于能量大小,A 错误。
B. 这一过程部分电子从外侧转移到内侧,因此释放能量,B 正确。
C. $3 \text p^2$ 表示 $3 \text p$ 能级上有两个电子,C 错误。
D. 不可能存在两个主量子数、角量子数、磁量子数和自旋量子数都对应相等的电子。因此不可能存在运动状态相同的电子,D 错误。
任务
当不考虑能级交错时,这一世界的排布规律如下:
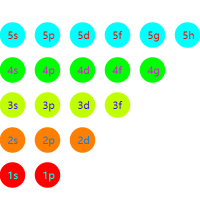
注意到磁量子数为 $\pm l$,因此只有当角量子数为 $0$ 时每个轨道可容纳 $1$ 个电子,其它情况均可容纳 $2$ 个电子。
题目询问的是第三个稀有气体,因此该元素应该正好排满了前三能层的所有轨道。
因此电子数为 $1+2+1+2+2+1+2+2+2=15$,即对应第 $15$ 号元素。